2022-11-11
目前已知的人类遗传疾病约60%是由碱基突变引起的,因此开发高效精准且安全的单碱基编辑器对基础研究和人类遗传疾病的治疗具有极为重要的意义。
2022年11月11日,聚焦于基因和细胞治疗的上海GA黄金甲生物科技有限公司(以下简称“GA黄金甲生物”)宣布,与华东师范大学李大力教授、刘明耀教授团队以及北京大学的伊成器课题组合作发现了一种可以大幅提升基因编辑准确性和安全性的技术。研究团队通过对腺嘌呤脱氨酶TadA-8e重新设计改造,改变了其对底物的识别和催化,变成仅编辑胞嘧啶的脱氨酶,创新性地开发了不依赖天然胞嘧啶脱氨酶AID/APOBEC家族的一系列精准且安全的新型胞嘧啶碱基编辑器——“Td-CGBE/Td-CBEs”(TadA-derived CGBE/CBEs),与目前最优化的胞嘧啶碱基编辑器BE4max相比,展现出了非常低脱靶编辑和indel事件,具备巨大的临床转化应用潜力。该项研究成果已于11月10日正式在国际学术期刊Nature Biotechnology上发表。

Nature Biotechnology发文
GA黄金甲生物新型胞嘧啶碱基编辑系统:“Td-CGBE/Td-CBEs”临床应用前景广阔
近年来,随着CRISPR/Cas9技术的发展,单碱基编辑技术因其高效和精确的基因编辑能力,成为当前最有希望治愈各种遗传疾病的明星工具。
碱基编辑技术最早由哈佛大学David R. Liu团队开发,他们通过将Cas9缺口酶(nickase)与APOBEC家族胞嘧啶脱氨酶以及通过分子进化得到的腺嘌呤脱氨酶TadA融合,开发出可实现C到T碱基转换的胞嘧啶碱基编辑器(Cytosine base editor, CBE)以及A到G碱基转换的腺嘌呤碱基编辑器(Adenine base editor, ABE)。这两类碱基编辑器能不依赖DNA双链断裂和同源重组修复机制,在分裂及非分裂细胞基因组DNA上实现高效的碱基转换。目前CBE与ABE虽已在多个物种中得到广泛应用,但通过不少实验研究表明,它们仍在安全性等方面存在隐患。如现有的CBE会产生显著的不依赖于Cas9的DNA和RNA随机脱靶,而且较宽的编辑窗口引起难以避免的旁观者效应。
在本次研究中,科研团队首先证明了ABE尤其是高活性ABE8e可介导高效的胞嘧啶编辑,由此开发了首款不依赖于天然AID/APOBEC家族酶的CGBE,命名为Td-CGBE(TadA-derived CGBE)。项目组基于结构导向的理性设计和筛选,发现在TadA-8e脱氨酶的活性口袋引入关键突变N46L,消除其固有的腺嘌呤脱氨酶活性而展现高效的胞嘧啶编辑活性,随后在27个靶点(包括4个富含多A的靶点)的测试进一步证明了该突变可完全消除腺嘌呤编辑活性,诱导高效率高纯度的C到G的转换,效率高达72.8%。令人惊喜的是,其相对于传统的CGBE编辑器,该突变体具有更低的indels,且编辑窗口显著缩窄到1-2个碱基 (C5-C6)。(图1)
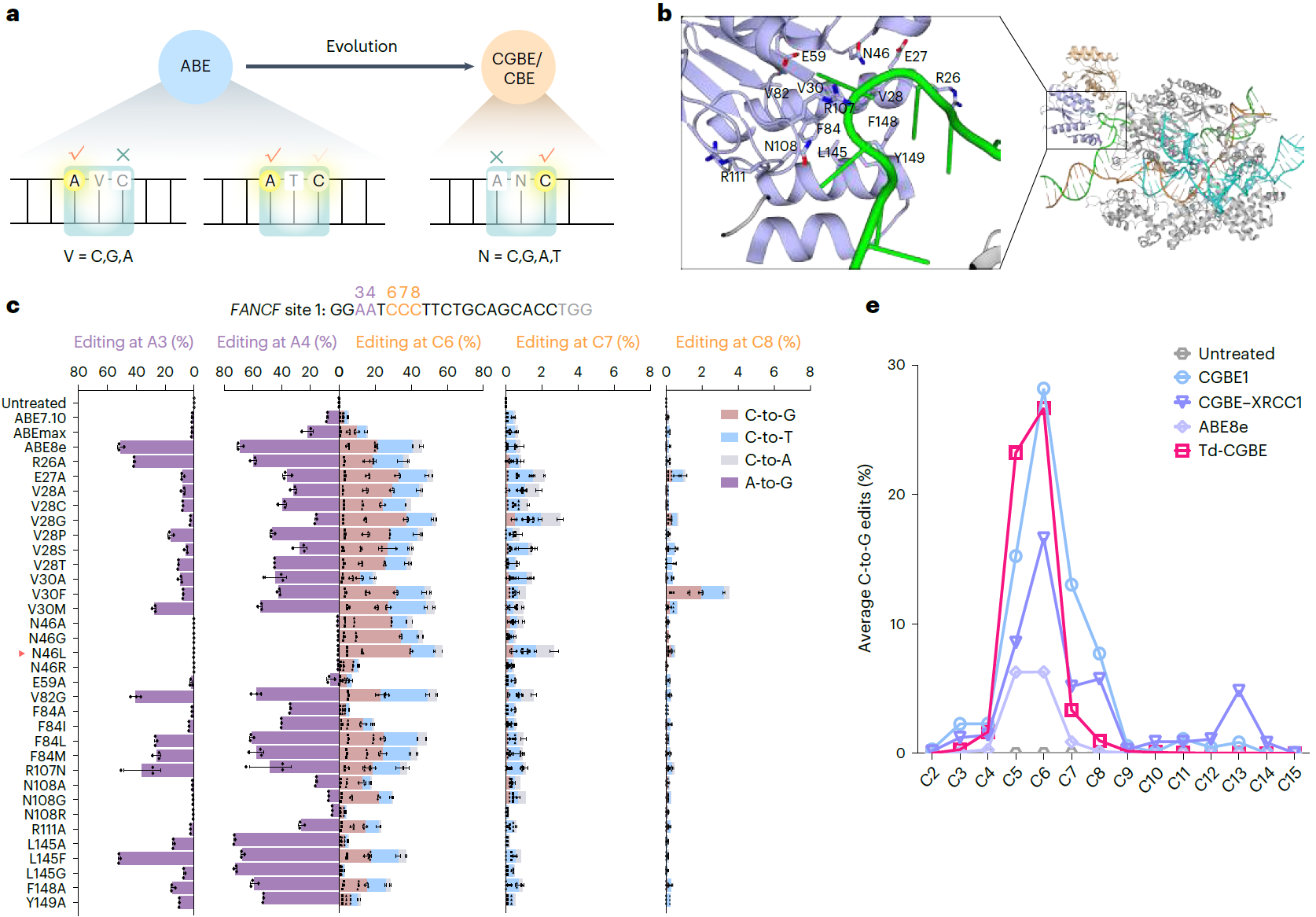
随后,项目组通过对TadA-8e结构中可能与底物相互作用的关键区段重新改造、linker序列以及UGI串联等多轮优化获得了一系列Td-CBEs,发现其依然表现为完全消除腺嘌呤编辑的特性,而且产生显著降低的indels频率。研究发现在Td-CBE的基础上去除linker序列并在TadA-8e-N46L的基础上引入P29A(eTd-CBEa)或A48M(eTd-CBEm)可保留较高的C到T编辑活性,并且显著缩小编辑窗口到sgRNA的第5或第6位,与基于APOBEC1来源的窄窗口BE4max-YEE相比,eTd-CBEs变体的精确度最高提升了131.4倍,且仅诱导背景水平的indels事件(图2)。可以说,Td-CGBE高精确度的特性为进一步开发精准的C到T的碱基编辑器奠定基础,能够解决传统CBE的精准性问题。
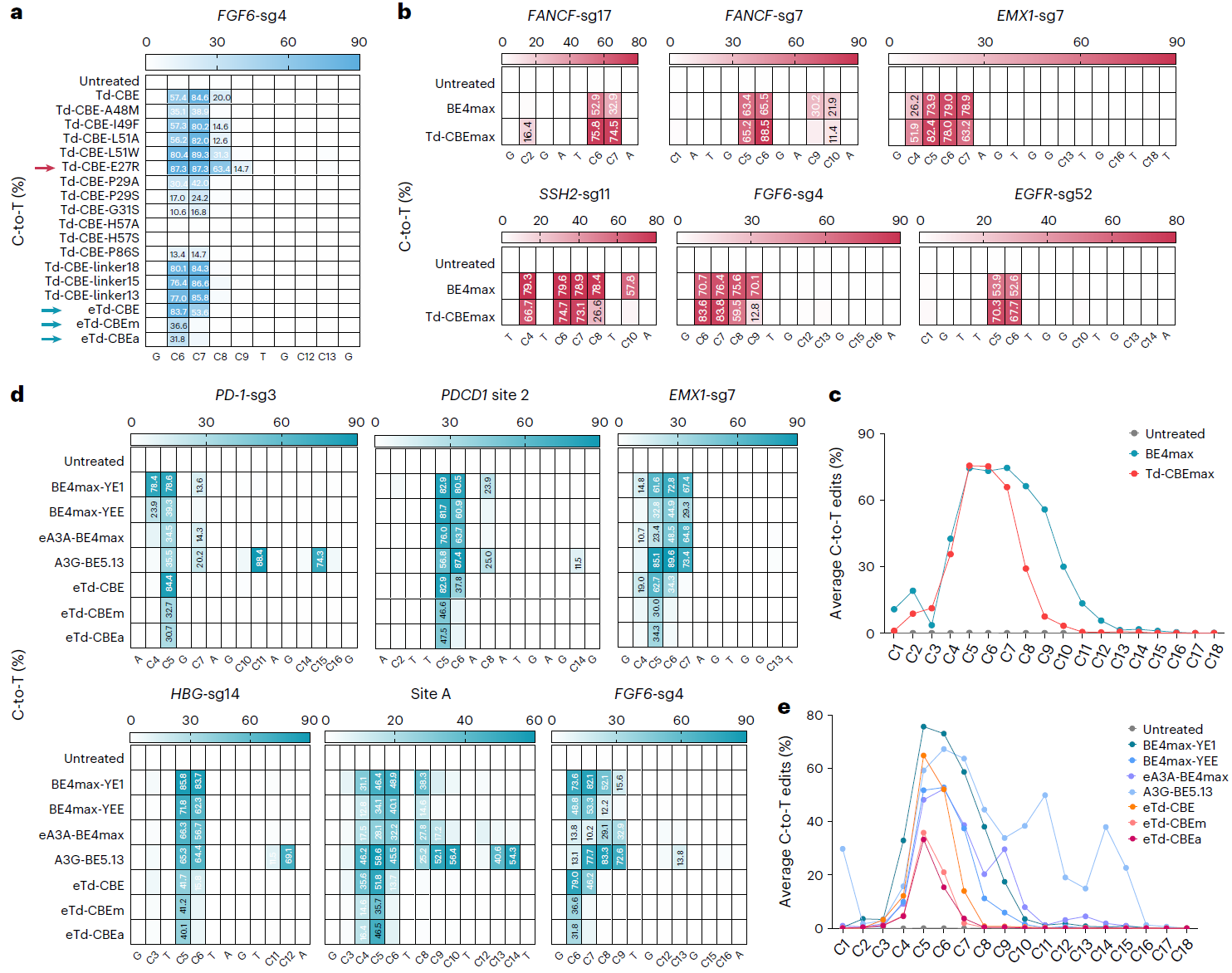
图2:Td-CBEs的优化及特性评价
此外令人兴奋的是,通过Cas9依赖性的脱靶位点、Cas9非依赖性脱靶的R-loop检测和项目组前期开发的最灵敏的Detect-seq 以及RNA脱靶的转录组分析发现,Td-CGBE/Td-CBEs变体几乎不引起随机的DNA和RNA脱靶编辑(图3),展示出了极高的应用安全性。并且Td-CGBE在小鼠胚胎中也表现出极高的体内编辑活性和精度。
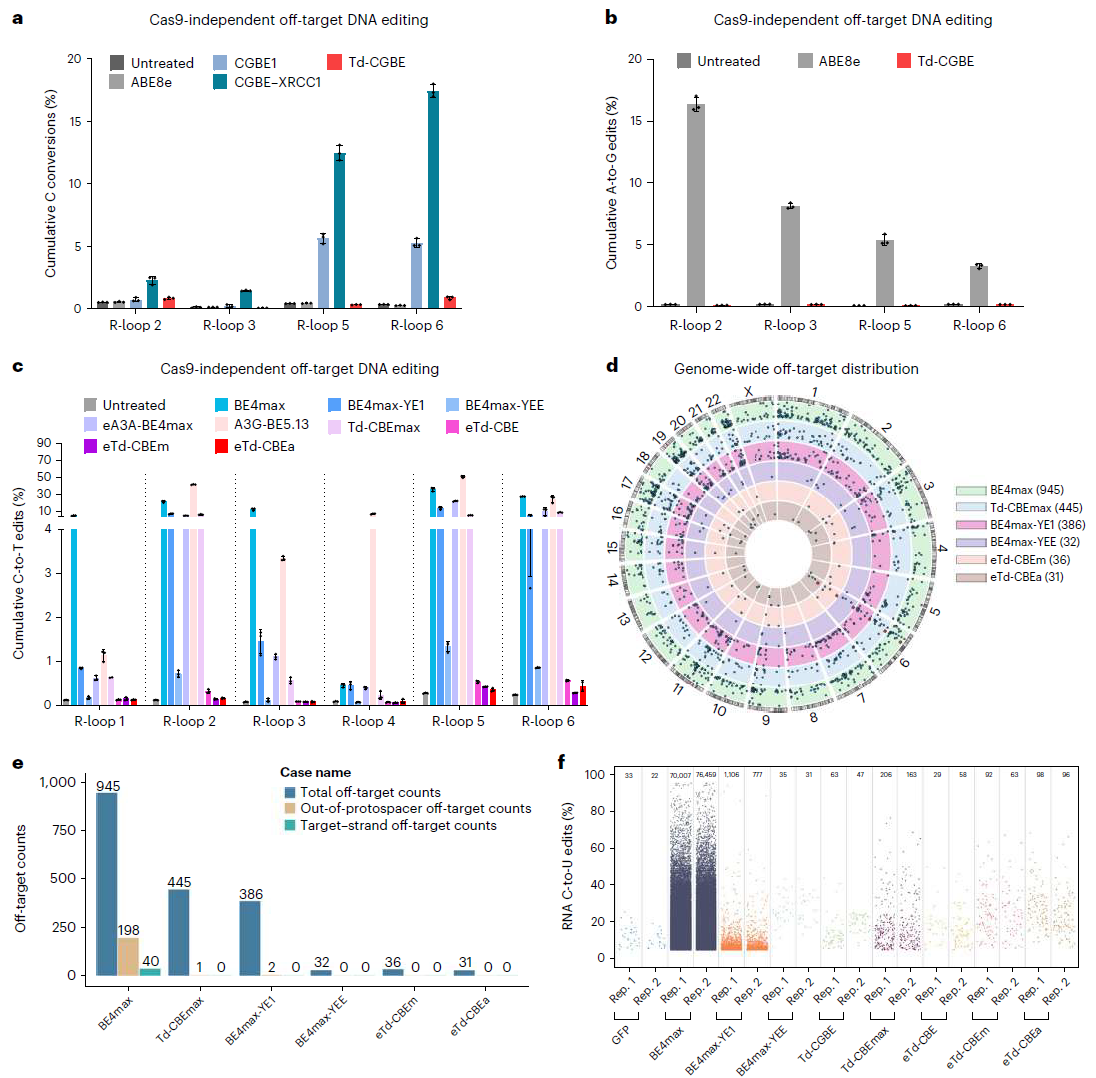
图3:Cas9非依赖DNA 脱靶、detect-seq和RNA脱靶评价
为进一步评估Td-CGBE/Td-CBEs变体基因治疗的潜能和其精准的特性,研究者评估了其在背景序列含有多个同源多聚胞嘧啶位点的致病单核苷酸变异(SNVs)的编辑情况,这些位点中需要纠正的胞苷处于sgRNA第五位且处于多个连续胞苷中。发现Td-CGBE/Td-CBEs能精准编辑sgRNA第五位的胞苷并产生所需的C-to-G/T转换,相对于传统CGBE/CBEs展现出更精准、高效地构建或纠正致病 SNVs位点的能力(图4)。
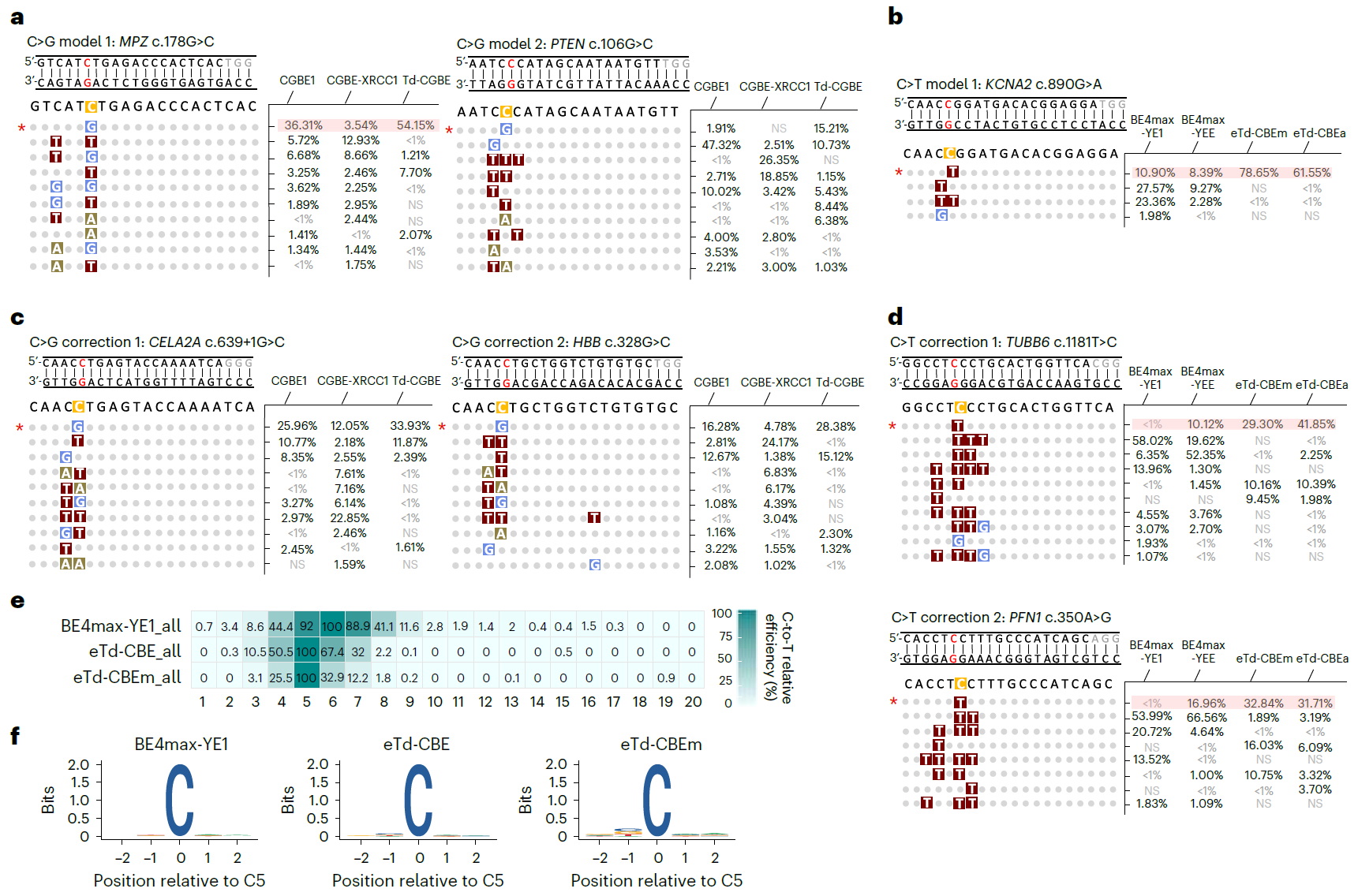 图4:Td-BEs变体纠正人类致病性的SNVs及靶向文库分析无偏见的评价eTd-CBEs编辑特性
图4:Td-BEs变体纠正人类致病性的SNVs及靶向文库分析无偏见的评价eTd-CBEs编辑特性
论文共同通讯作者,GA黄金甲生物联合创始人&副总裁李大力教授表示:“在本次研究中,为了无偏见地分析eTd-CBEs的精准编辑特性,该研究还采用含有8954条sgRNA与靶点配对的文库进行编辑窗口的分析,证明了其广泛地精准编辑特性。并且由于其无编辑序列偏好,将来还可以与识别不同PAM的Cas蛋白变体融合,进一步扩大靶向范围。总的来说,该项研究创造性地通过蛋白改造,将以腺嘌呤为底物的脱氨酶TadA-8e改造成为仅以胞嘧啶为底物的非天然胞嘧啶脱氨酶,并构建了第一个不依赖AID/APOBEC 脱氨酶家族的新型胞嘧啶碱基编辑系统,其表现出了与BE4max系列编辑器相当的编辑效率,并且编辑窗口更加精准,脱靶率极低,接近背景水平。不仅为未来开发新的碱基编辑技术提供了新思路,更为重要的是有望极大提高将来临床应用的安全性。”
GA黄金甲生物在单碱基编辑工具开发领域持续发力,助力产品全面布局
作为一家全球最早进行基因编辑技术研发和应用的企业之一,GA黄金甲生物自2013年成立以来,一直坚持技术创新,不仅不断克服行业壁垒进行多管线战略布局,同时致力于开发国际领先的基因编辑工具,获得具有自主知识产权的核心技术。
目前,GA黄金甲生物科学家团队在基因编辑工具开发、基因治疗地中海贫血以及CAR-T技术创新领域,已经取得很多重磅、突破性进展。近1年来,GA黄金甲生物已在国际著名学术期刊Nature、Nature Medicine、Nature Biotechnology、Nature Chemical Biology等发表多篇学术论文,特别是在单碱基编辑工具开发领域的相继突破,为基础研究和遗传性疾病如β-地中海贫血的治疗提供了新的发展方向和工具。
对此,论文共同通讯作者,GA黄金甲生物创始人&董事长刘明耀教授表示,“本次高精度新型胞嘧啶碱基编辑系统‘Td-CGBE/Td-CBEs’的开发,是GA黄金甲生物继开发出ABE9新型腺嘌呤碱基编辑器后在单碱基编辑工具开发领域的又一次革命性创新。此次碱基编辑器的优化升级及安全性的完善,为人类遗传疾病的基因治疗带来了新希望。而GA黄金甲生物作为一家细胞基因药企,一直以来都注重在底层基因编辑技术方面不断探索,着眼于基因药物和细胞药物的开发。目前,GA黄金甲生物已与国内多家医疗单位合作,在基因编辑治疗β-地中海贫血症、非病毒PD1定点整合CAR-T、以及UCART等项目中已经取得优异临床效果。未来,GA黄金甲生物仍将依托坚实的基础研发实力,不断地加速推进创新药物的转化与落地,造福全球遗传疾病、恶性肿瘤及自身免疫系统疾病等患者;并致力于改写和引领中国新一代药企在全球生命科技领域格局!”